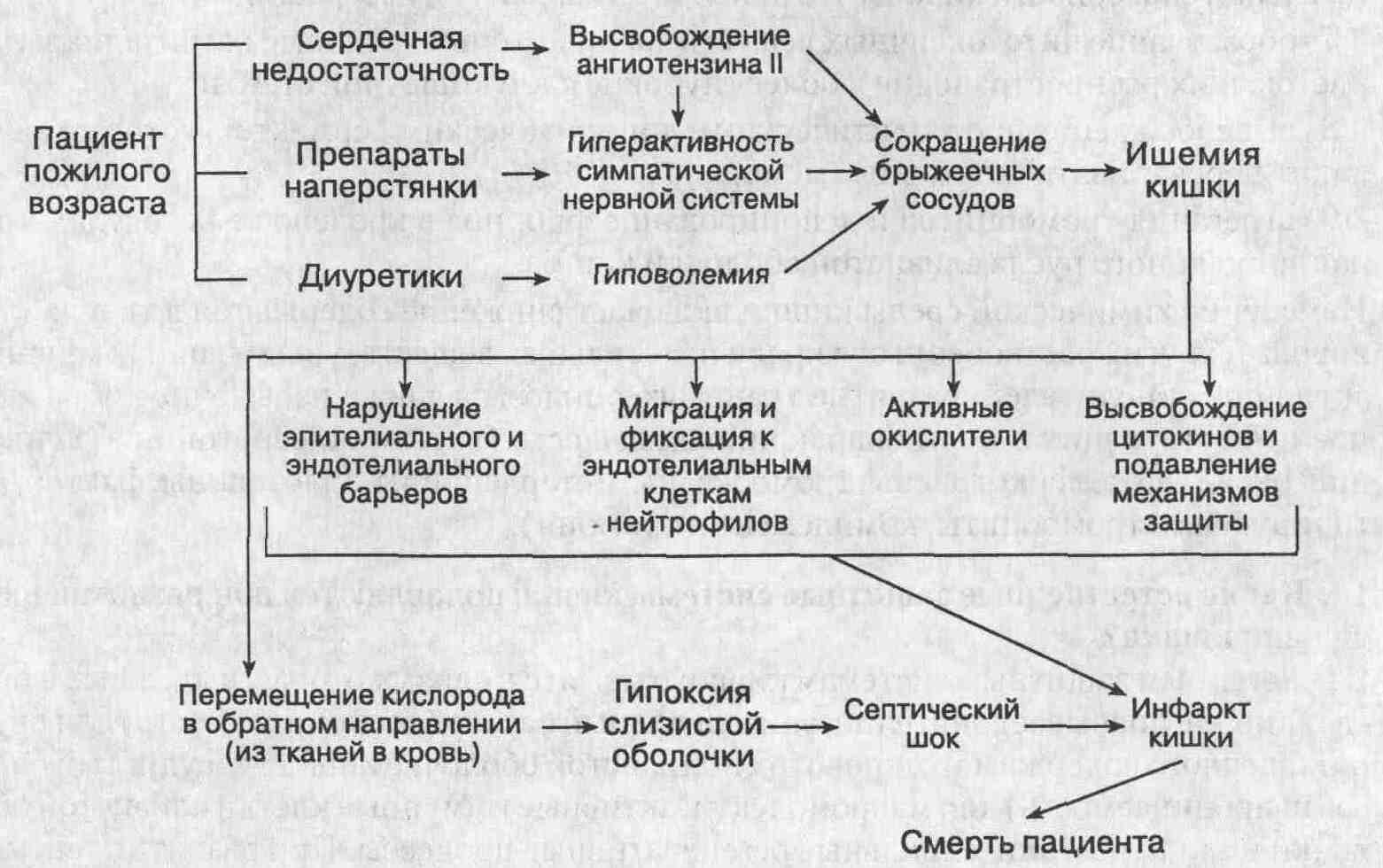
Муковисцидоз (кистофиброз поджелудочной железы) – системное
наследственное заболевание, при котором поражаются экзокринные железы. Причиной
муковисцидоза является генная мутация, передающаяся по аутосомно – рециссивному
типу.
Выделяют следующие основные формы муковисцидоза:
- смешанная (легочно-кишечная, 75-80%)
- респираторная (15-20%)
- кишечная (5%).
Смешанная форма является наиболее тяжелым проявлением муковисцедоза. С
первых недель жизни отмечаются повторные тяжелые бронхиты и пневмонии с
затяжным течением, постоянный кашель, нередко коклюшепобный, с вязкой мокротой,
кишечные нарушения и расстройства питания. Нарушения бронхиальной проводимости
является неотъемлемой частью бронхо-легочных изменений. Нарушение процесса
самоочищения приводит к закупорке бронхиол и мелких бронхов. Типичными
изменениями являются постоянные разноколиберные хрипы, которые выслушиваются
обычно с двух сторон. Перкуторный звук носит коробочный оттенок.
Рентгенологическая картина характеризуется распространенностью и большой
пестротой легочных изменений. Сочетание эмфиземы и резко усиленного и
деформированного легочного рисунка даже вне обострения создает довольно
типичную картину.
При бронхологическом исследовании выявляются распространенные бронхиальные
деформации имеющие ряд типичных для муковисцидоза признаков: каплевидные
бронхоэктазы, изменения хода бронхов, а также четкообразная неравномерность
просвета бронхов III-VI порядка. При исследовании функции внешнего дыхания
обычно наблюдаются выраженные обструктивные нарушения.
При длительном течении муковисцедоза почти постоянно наблюдаются поражения
носоглотки, аденоиды, полипы носа. Почти у всех детей обнаруживается синусит,
клиническим проявлением которого являются обильная секреция, головные боли,
гнусавость голоса.
Клиническая симптоматика кишечного синдрома складывается из симптомов
нарушения функций поджелудочной железы и кишечника. В кишечнике возникают
гнилостные процессы, сопровождающиеся накоплением газов, в результате чего
живот постоянно вздут. Характерен обильный, жирный, замазкообразный стул с
неприятным гнилостным запахом, что иногда позволяет заподозрить муковисцидоз
уже при первом осмотре больного.
Микониальный илеус развивается у 10-15% больных в периоде новорожденности. В
первые дни жизни ребенка появляютсясимптомы кишечной непроходимости: рвота с
примесью желчи, неотхождение мекония, увеличение живота. Весьма опасным
осложнением является мекониевый перитонит. Мекониальный илеус принято считать
проявлением тяжелой формы муковисцедоза.
Лечение муковисцидоза
Диета больного муковисцидозом должна соответствовать возрасту, содержать
повышенное на 10-15% количество белка и нормальное количество жиров и
углеводов. При этом в рацион включают только легко усваиваемые жиры (сливочное
и растительное масло). Пища не должна содержать грубую клетчатку. У детей с
вторичной лактазной недостаточностью исключают молоко. При выраженном кишечном
синдроме и симптомах, обусловленных недостаточностью различных витаминов,
парентерально назначают витамины.
При кишечном синдроме с заместительной целью применией, гиповитаминозом, сердечной недостаточностью. Для
уменьшения вязкости мокроты применяют ингаляции ферментных препаратов
(химопсина, химотрипсина, кристаллического фибринолизина) или муколитических
препаратов, ацетилцистеина, мукосольвина. С целью разжижения мокроты
ацетилцистеин и мукосольвин можно назначать внутримышечно, а мукосольвиия и подбирается индивидуально. Критериями достаточности дозы являются
исчезновение болей в животе, нормализация стула, отсутствие нейтрального жира
при копрологическом исследовании, нормализация веса. Ферментные препараты
принимают во время еды.
Лечение легочного синдрома включает мероприятия по уменьшению вязкости
мокроты и улучшению дренажа бронхов, антибактериальную терапию, борьбу с
интоксикацией и гипоксией, гиповитаминозом, сердечной недостаточностью. Для
уменьшения вязкости мокроты применяют ингаляции ферментных препаратов
(химопсина, химотрипсина, кристаллического фибринолизина) или муколитических
препаратов, ацетилцистеина, мукосольвина. С целью разжижения мокроты
ацетилцистеин и мукосольвин можно назначать внутримышечно, а мукосольвин также
и внутрь. Более слабый разжижающий эффект оказывают бромгексин и мукалтин. Для
улучшения дренажа бронхов проводят вибрационный массаж грудной клетки, лечебную
гимнастику, постуральный дренаж, v детей раннего возраста мокроту удаляют
электроотсосом.
При обострении легочного процесса назначают антибактериальную терапию сроком
не менее чем на 3-4 нед. Антибиотики подбирают с учетом антибиотикограммы, но
если это исследование провести невозможно, то основываются на том, что наиболее
часто возбудителями воспалительного процесса в легких у больных М. являются
стафилококк и синегнойная палочка. Одновременно с антибиотиками используют
противогрибковые (нистатин, чеворин) и антигистаминные препараты. В период
обострения проводят также УВЧ-, СВЧ-терапию. а затем электрофорез препаратов
пода и магния (препараты кальция противопоказаны, т.к. они усиливают
пневмосклероз); назначают поливитамины, для уменьшения легочной гипертензии -
эуфиллин по 7-10 мг/кг массы тела в сутки внутрь (дозу делят на 3 приема) в
течение 4-5 нед. от начала обострения. Показаны препараты, улучшающие метаболизм
миокарда: оротат калия, кокарбоксилаза. При декомпенсации легочного сердца
применяют сердечные гликозиды (дигоксин), глюкокортикоиды (по 1-1,5 мг/кг в
сутки в пересчете на преднизолон с учетом суточного ритма надпочечников в
течение 3-4 нед.). Глюкокортикоиды в такой же дозе назначают и при быстром
прогрессировании пневмосклероза, а при хронической надпочечниковой
недостаточности, развившейся в результате гнойной интоксикации и гипоксии, - в
дозе 0,4 мг/кг в сутки по преднизолону с учетом суточного ритма.
Дети, больные муковисцидозом, находятся под диспансерным наблюдением
участкового врача и пульмонолога, т. к., несмотря на генерализацию процесса и
изменения во многих органах и системах, поражение органов дыхания отмечается у
большинства больных и именно оно определяет тяжесть и прогноз заболевания.
Родители должны быть обучены уходу за больным и таким методам лечения, как
массаж, лечебная гимнастика, аэрозольтерапия. Задачами диспансерного наблюдения
являются контроль за функциональным состоянием бронхолегочной,
сердечно-сосудистой систем, желудочно-кишечного тракта, почек, печени и
правильностью дозы ферментных препаратов, своевременное лечение при обострении
заболевания, проведение общеукрепляющей терапии, в периоде ремиссии - санация
очагов хронической инфекции. Лечение осуществляют амбулаторно и в домашних
условиях, где ребенку может быть обеспечен индивидуальный уход и исключена
реинфекция. Лишь при тяжелом состоянии или наличии осложнений показана
госпитализация. Интенсивную терапию проводят больным с дыхательной
недостаточностью II-III степени, с декомпенсацией легочного сердца, с
плевральными осложнениями, деструкцией легких, кровохарканьем Оперативное
вмешательство показано при мекониальной непроходимости, при отсутствии эффекта
от консервативной терапии при кишечной непроходимости у детей более старшего
возраста, иногда при деструкции в легких. При бронхоэктазах хирургическое
лечение не рекомендуется, т.к. процесс всегда распространенный.
Больные муковисцидозом дети получают все лекарства для амбулаторного лечения
бесплатно.
Детям с легкими и среднетяжелыми кишечными формами М. показано санаторное
лечение. Для детей с легочной формой М. полезно санаторное лечение, если есть
возможность создать специальные группы. Больных М. рекомендуется направлять в
местные санатории. Критериями отбора в санаторий являются компенсация кишечных
расстройств при назначении ферментных препаратов, отсутствие декомпенсации
легочного сердца и воспалительного процесса в легких.
Пребывание больных муковисцидозом в детских дошкольных учреждениях
нецелесообразно. Посещение школы при хорошем и удовлетворительном состоянии
возможно, но необходим дополнительный выходной день в неделю и свободное
посещение школы в дни лечения и обследования в поликлинике (при
пульмонологическом центре), освобождение от экзаменов. Вопрос о возможности
прививок детям, больным муковисцидозом, решается индивидуально.
Больные муковисцидозом дети с диспансерного учета не снимаются, а по
достижении 15-летнего возраста передаются под наблюдение терапевта в поликлинику
для взрослых.
Больные муковисцидозом живут
дольше, но остается еще много проблем
 версия для
печати версия для
печати
По данным фонда муковисцидоза Cystic Fibrosis Foundation средняя
продолжительность жизни больных с муковисцидозом (кистофиброзом поджелудочной
железы) существенно возросла и составляет сейчас в среднем 35 лет. В
настоящее время Взрослые составляют до 40% больных муковисцидозом. В
последние годы продолжительность жизни выросла примерно на 50%.
Основными факторами, которые улучшают ожидаемую продолжительность жизни и её
качество являются более агрессивная стратегия питания, улучшение
эффективности антибиотиков и муколитиков, а так же развитие Центров
специализированной помощи.
Средний больной муковисцидозом уже сегодня может испытать радости семейной
жизни, посещает колледж и делает карьеру.
Однако остаются еще проблемы, которые необходимо решить: 1) бактерии, которые
трудно поддаются лечению. Примерно 80% пациентов к 18 годам колонизируют
бмикроорганизмом Pseudomonas. С течением времени эта бактерия становится все
более резистентна к антибиотикам.
2) Важной проблемой являютя заболевания легких. У молодых людей имеются
большие резервы, но у четверти пациентов жизненная емкость легких более е чем
на 40 процентов меньше, чем должная.
Муковисцидоз не только разрушает легкие, но и закупоривает слизистыми
пробками протоки поджелудочной железы. В результате ферменты поджелудочной
железы не поступают в пищеварительный тракт, а пища не может всасываться.
Неполадки с поджелудочной железой продолжают укорачивать жизнь пациентам. У 20
- 25% пациентов с кистофиброзом развивается диабет. Средний возраст «дебюта»
диабета от 18 дo 24 лет.
Ломкость костей при этом заболевании отмечается еще внутриутробно. Примерно у
67% наблюдается истончение костей и остеопороз. Это связано с тем, панкреатическая
недостаточность нарушает процессы переваривания жира, усвоения
жирорастворимых витаминов A, E, K и в особенности D, который критичен для
прочности костей. Регулярные физические упражнения способствуют укреплению
костей, но заниматься физкультурой больные кистофиброзом из-за дыхательной
недостаточности не могут.
Дела семейные
С рождением потомства у мужчин с муковисцидозом возникают проблемы. Более 95%
мужчин с муковицидозом – стерильны. При муковисцидозе часто могут наблюдаться
может врожденное отсутствие vas deferens — неправильное развитие протока,
который обеспечивает продвижение спермы из яичек.
У женщин так же снижена плодовитость. Они могут иметь детей, но при тяжелых
формах муковисцидоза часто возникают проблемы с зачатием из – за нарушений
питания. Плюс к этому нарушение функций легких могут вызвать проблемы с
беременностью. При проблемах с зачатием выходом могут быть приемные дети или
использование донорской спермы. Например, может быть применено
интрацитоплазматическое введение спермы, (intracytoplasmic sperm injection
(ICSI), при этой процедуре сперма вводится непосредственно в цитоплазму
зрелых яйцеклеток. Однако ICSI стоит $10,000 за каждуюинъекцию без каких либо
гарантий успеха.
Психологическая картина: решению завести семью мешает ощущение приближающейся
смерти. Даже если они и смогут иметь детей, у них не всегда будет время
«поставить их на ноги».
Методом терапии отчаяния остается трансплантация легких. Этот метод лечения
рекомендуется в том случае, если функция легких падает до 30%. Однако после
трансплантации живут более 5 лет только 60% пациентов. По мнению многих
ученых трансплантация легких не столько продлевает жизнь, сколько улучшает её
качество.
|
|
|
Особенности диабета, связанного с кистофиброзом
(результаты эпидемиологического исследования).
|
|
|
|
|
|
|
22.06.05
|
|
Диабет, связанный
с кистофиброзом (ДСКФ) – это особая форма заболевания, сочетающая признаки
диабета 1 и 2 типа, обусловленная, главным образом, дефицитом инсулина
вследствие поражения поджелудочной железы. Развитие такого тяжелого
осложнения кистофиброза (КФ), каким является диабет, связано, прежде всего, с
увеличением продолжительности жизни больных.
В США 16,9% больных КФ старше 13 лет страдают ДСКФ, требующим постоянной
инсулинотерапии. Проведенные ранее исследования показали, что ДСКФ оказывает
негативное влияние на состояние легких, печени, обмен веществ, а также
ассоциируется с прогрессированием заболевания и повышенной смертностью
больных. Авторы предприняли настоящее исследование с целью изучить факторы
риска развития ДСКФ, его влияние на функцию легких и нутритивный статус
больных, а также течение заболевания и развитие осложнений.
Методы и ход исследования.
В работе использовались данные эпидемиологического исследования по КФ (США,
1999). Из 10 697 пациентов в возрасте ≥13 лет, принимавших участие в исследовании,
в настоящую работу включили 8247 больных (77%), которые обследовались врачом
хотя бы 1 раз в течение 1998
г. ДСКФ определяли как состояние, требующее
использования инсулина или пероральных гипогликемических препаратов.
Пациентов разделили на группы в зависимости от возраста : 13-17 лет, 18-25
лет, 26-35 лет и старше 35 лет. Для характеристики функции легких
использовали последнее исследование функции внешнего дыхания (ФВД, параметры
в % от должного), когда больной находился в стабильном состоянии. Оценивались
данные физического развития (вес и рост в процентилях для соответствующего
возраста), микробиологического исследования мокроты, объем проводимого
лечения и осложнения основного заболевания.
Результаты.
54,4% больных КФ были женского пола, 45,6% - мужского. ДСКФ чаще встречался у
женщин (17,1%), чем у мужчин (12%). Средний возраст больных ДСКФ (1
гр.) был 25,9 лет, больных без ДСКФ (2 гр.) – 22,5 лет.
ДСКФ значительно чаще встречался среди больных, имевших недостаточность
поджелудочной железы (15%), чем без таковой (5,7%, р<0,001). Кроме того,
ДСКФ гораздо чаще выявлялся среди больных, гомозиготных по δ F508 гену (1586
пациентов из 3160 обследованных). Данная закономерность прослеживалась во
всех возрастных группах, причем, с увеличением возраста пациентов повышалось
количество больных ДСКФ: 13-17 лет – 8%, 18-25 лет – 20,5%, 26-35 лет –
25,5%, старше 35 лет – 27%.
Исследование ФВД (спирометрия) выполнено у 89,2% больных. ДСКФ встречался
значительно чаще среди пациентов с тяжелой патологией легких, составляя 22,6%
больных с тяжелыми вентиляционными нарушениями (объем форсированного выдоха
за 1 секунду (ОФВ1) <40%), 16,4% - с умеренно выраженными (ОФВ1=40-70%),
9,1% - с легкими расстройствами (ОФВ1=70-100%) и 5,9% - с нормальной ФВД
(ОФВ1>100%). Среднее значение ОФВ1 у больных 1 гр. было 55,4%, в то время
как во 2 гр. – 67,5%. Сходные результаты были получены во всех возрастных
категориях, но наиболее значимые различия зарегистрированы у подростков – 65%
и 77,4% соответственно.
Больные ДСКФ имели большее количество обострений бронхолегочной патологии, в
лечении которой использовали парентеральные антибиотики – 1,55 в течение
года, по сравнению с 0,78 год во 2 гр. Если 60,7% пациентов без ДСКФ вообще
не имели обострения легочного процесса в течение 1998 г., то в группе с
ДСКФ таких было всего 36,4%. Еще большая разница выявлялась по отношению к
частым бронхолегочным обострениям: в 1 гр. ими страдало 23,6% больных, во 2
гр. - всего 9,5%. Подобное соотношение прослеживалось во всех
возрастных категориях.
Результаты микробиологического исследования, выполненного у 84,9% больных,
отличались в обеих группах. У пациентов с ДСКФ в микробиологическом пейзаже
превалировали Pseudomonas aeruginosa (84,1% против 77,2% во 2 гр.), комплекс
Burkhdderia cepacia (10,3% против 5,2%), Stenotrophomonas maltophilia (8,6%
против 6,1%), Candida (23,3% против 16,5%) и Aspergillus (18,8% против
13,9%). Наиболее значимым было преобладание комплекса B.cepacia, причем в
каждой возрастной категории.
Исследование нутритивного статуса у 97,9% больных показало значительные
нарушения у пациентов с ДСКФ: отставание роста (28,9 процентиль, во 2 гр. –
35,3), дефицит веса (28,3 против 32,7), низкие значения индекса массы тела
(20,5 против 20,6).
Частота использования лекарственных препаратов для лечения легочной патологии
различалась у пациентов двух групп, в том числе, в отношении пульмозима
(α-ДНКазы) – 57,6% в 1 гр. и 49,8% во 2 гр., муколитиков – 90,7% и 84,3%,
ингаляционных (91,5% и 84,3%) и пероральных (21,5% и 13,7%) бронхолитиков, а
также кислородотерапии (24,2% и 9,7%). Пищевые добавки – оральные (40,5% и
32,7%), энтеральные (11,7% и 7,7%) и парентеральные (2,4% и 0,9%), системные
(27,6% и 17,9%), и ингаляционные (48,9% и 39,6%) кортикостероиды и
контрацептивы (12,7% и 7%) также чаще использовались в группе с ДСКФ.
Различные осложнения регистрировались с большей частотой у больных с ДСКФ,
включая аллергический бронхолегочный аспергиллез (6,5% в 1 гр. против 3,6% во
2 гр.), бронхиальную астму (27,8% и 23,8%), синуситы (26,6% и 20,4%),
сердечную недостаточность (1,5% и 0,3%) и цирроз печени (4,6% и 1,8%).
Использование многофакторного регрессионного анализа позволило доказать, что
пол (женский), возраст (>35 лет) и недостаточность поджелудочной железы
чаще всего ассоциируются с развитием ДСКФ. Тяжесть респираторной дисфункции и
число легочных обострений также сочетаются с ДСКФ. Пациенты с нарушенным
нутритивным статусом и отставанием роста имеют повышенный риск развития ДСКФ.
Кроме того, формирование ДСКФ ассоциируется с такими факторами как
использование оральных или имплантированных контрацептивов, наличие в мокроте
Р.aeruginosa или комплекса В.сepacia, развитие патологии печени (цирроза
печени, портальной гипертензии или повышения функциональных печеночных
тестов) и аллергического бронхолегочного аспергиллеза.
Выводы.
Проведенное эпидемиологическое исследование позволило авторам впервые
установить, что больные с ДСКФ имеют более тяжелую легочную патологию,
протекающую с частыми обострениями, повышенную обсемененность мокроты патогенными
микроорганизмами, а также нарушенный нутритивный статус и высокую частоту
поражения печени.
Кроме того, авторы подтвердили уже известные данные о том, что развитие ДСКФ
ассоциируется со старшим возрастом больных, женским полом, панкреатической
недостаточностью и δ F508 гомозиготным генотипом.
Ограничения, которые были в работе, как указывают авторы, это сам характер
исследования (регистрация данных, а не клиническое исследование), выявление
диабета лишь по использованию больными противодиабетических препаратов (а не
активный скрининг патологии), отсутствие доказательств причинной связи между
ДСКФ и тяжелым состоянием больных (что первично, а что вторично). Тем не
менее, подчеркивают авторы, это самое крупное исследование, демонстрирующее,
что ДСКФ – наиболее грозное осложнение у подростков и взрослых с КФ, которое
ассоциируется с более тяжелым течением заболевания.
Источник.
B.C.Marshall e.a. Epidemiology Of Cystic Fibrosis-Related Diabetes. . The
Journal of Pediatrics. May 2005;146: 681-7.
|
Лекарственные поражения поджелудочной железы
Сложная регуляционная система поджелудочной железы и высокая биологическая
активность ее структур - ацинарные клетки, островки Лангерганса, канальцевый
эпителий - обусловливают значительную ранимость этого органа и его широкое
участие в ряде патологических состояний. Проявления поражений поджелудочной
железы большей частью отличаются клинической невыраженностью и однотипностью и
очень часто теряются среди клинических симптомов, сопутствующих поражениям
других органов. Этим своеобразием патогенеза и объясняется незначительная
известность лекарственных поражений поджелудочной железы. Если же учесть
своеобразную структуру и функциональные особенности этого органа, то следовало
бы предположить, что такие поражения на самом деле нередки.
Лекарственные нарушения внешней секреции поджелудочной железы
Угнетение всей
экзокринной
функции - канальцевой и ацинарной - поджелудочной железы наблюдается при
лечении большими дозами холинолитических препаратов - естественных (атропин и
белладонна, скополамин) и синтетических (бантин, пробантин, антренил и др.). По
данным Dreiling, некоторые из холинолитиков пипиридинового ряда в состоянии
тормозить
экзокринную
функцию поджелудочной
железы
до 95%. Hudock и др. удалось подавить до 40%
экзокринной
функции поджелудочной
железы
серотонином. Интересный эффект на
экзокринную
функцию поджелудочной
железы
оказывает ацетазоламид (диамокс, фонурит). Предполагают, что секрет
канальцевого эпителия в значительной степени обусловлен активностью
карбоангидразы, которой особенно богаты клетки этого эпителия. Угнетение
активности этого энзима даже лечебными дозами ацетазоламида может привести к
снижению до 50%
экзокринной
секреции
железы .
Существуют различные мнения в связи с секретогенным действием кортикостероидных
гормонов и АКТГ. По данным Певчих, это действие зависит в значительной мере от
базальной секреции железы. При пониженной секреции лечение этими препаратами приводит
к ее нормализации, а при нормальной секреции - к ее повышению. Интересны
исследования Шлыгина и сотр. Используя некоторые антиметаболиты - аминоптерин
(антиметаболит фолиевой кислоты) и З-ацетилпиридин (антиметаболит никотиновой
кислоты), им удалось полностью прекратить
экзокринную
секрецию поджелудочной
железы
с чувствительным понижением величин энзимов и бикарбонатов.
Лекарственное угнетение
экзокринной
функции поджелудочной
железы
почти не имеет клинических проявлений: по-видимому, угнетение этой функции
компенсируется повышенной секрецией кишечных энзимных систем.
Лекарственная инактивация панкреатических энзимов. Концентрация ряда
лекарственных средств в двенадцатиперстной кишке заметно выше, чем в других
отделах пищеварительной системы. Эта концентрация обусловливается, с одной
стороны, наличием все еще не подвергшихся всасыванию количеств лекарственных
веществ, а, с другой - поступлением других с желчью и панкреатическим соком.
Подобные явления имеют особое значение при лечении антибиотиками
тетрациклинового ряда, которые выделяются в довольно высоких концентрациях (до
128 мм/ мл) и в неизменном виде с желчью. Исследования Dickhoff и др. показали,
что такие концентрации могут оказать угнетающее воздействие на активность ряда
панкреатических энзимов. Угнетающий эффект тетрациклиновых препаратов на
панкреатические энзимы усиливается наличием солей кальция и уменьшается солями
желчной кислоты. По мнению Rick, ингибирующий эффект ряда антибиотиков на
панкреатические энзимы, главным образом на липазу, едва ли имеет практическое
значение, и его вряд ли можно было бы обвинить в диспептических явлениях,
весьма часто развивающихся при лечении антибиотиками.
Лекарственные панкреатиты
Еще недавно лекарственные поражения поджелудочной железы считались
казуистической редкостью. Однако за последние годы они наблюдаются сравнительно
часто, причем наряду с их числом растет и число лекарственных средств, которые
могут стать причиной их появления. По сведениям Scott, в настоящее время
известно свыше 20 лекарственных средств, применение которых может
сопровождаться развитием острого
панкреатита.
Среди лекарственных панкреатитов сравнительно давно известны панкреатиты,
обусловленные лечением кортикостероидами и АКТГ - так называемые «стероидные
панкреатиты». Действительную частоту этих панкреатитов установить очень трудно.
В литературе имеются сообщения лишь об единичных случаях или небольших группах
- по 3-5 больных. Обычно это больные, получавшие в течение долгого времени
большие дозы кортикостероидов по другим показаниям, чаще всего по причине
ревматоидного
артрита, нефротических состояний. По Ban стероидный панкреатит сравнительно
реже встречается у детей. В то время как этот панкреатит редко выявляется
клинически, удивительно часто его наблюдают на вскрытии, - по Сагопе - у 28,5%
из 54 больных, которых долго лечили кортикостероидами. Поражения поджелудочной
железы типа острого панкреатита удалось получить и у подопытных животных,
главным образом, у кроликов, после продолжительного введения этих гормонов.
Точные патогенетические механизмы стероидного панкреатита еще не вполне
выяснены. Выраженное в свое время предположение об аллергическом происхождении
этого заболевания по-видимому верно только в отношении единичных случаев.
Вследствие нарушения гормональной регуляции повышается вязкость
панкреатического сока, который осаждается в канальцах и приводит к застою сока
с последующим активированием энзимных систем. Это предположение подкрепляется и
частой аутопсионной находкой сгущенного секрета с закупоркой и расширением
мелких канальцев. Несомненно в возникновении стероидного панкреатита играют
роль и некоторые из проявлений основного заболевания, такие, как гиперлипемия
при нефротических состояниях, иммунные аберрации при ревматоидом артрите.
По-видимому, природа препарата особого значения не имеет стероидные панкреатиты
наблюдались при приеме как «старых» гормональных препаратов, так и новейших
полусинтетических стероидов.
Клинически стероидные панкреатиты могут иметь весьма разнообразные симптомы. У
значительного числа умерших на вскрытии обнаруживали панкреатит, проявлений
которого при жизни не наблюдалось. У нашего больного
язвенным колитом,
которого интенсивно лечили кортикостероидными гормонами, на вскрытии обнаружили
тяжелый некротический панкреатит при полном отсутствии его проявлений при
жизни. По-видимому, продолжительное гормональное лечение в таких случаях
серьезно меняет чувствительность и реактивность больного - так называемый
«маскирующий эффект». По мнению этого же автора, стероидные панкреатиты
выявляются клинически чаще всего при прекращении лечения или уменьшении
дозировки лекарства.
В выявленных случаях клинические проявления и лабораторные данные при
стероидных панкреатитах такие же, как и при «спонтанном» остром панкреатите.
Следует отметить подчеркнуто тяжелые морфологические проявления и почти всегда
смертельный исход. Эти особенности проявлений, течения и исхода стероидных
панкреатитов обусловлены как собственно изменениями в железе, так и основным
заболеванием.
Правильный диагноз острого стероидного панкреатита в тех случаях, когда
известно основное заболевание и то, что его лечили кортикостероидными
препаратами, не составляет особого труда. Трудность постановки диагноза
наблюдается в случаях с нечетко выраженными, соответственно отсутствующими клиническими
и лабораторными симптомами. Так, из 6 случаев, наблюдавшихся Nelk, правильным
оказался диагноз только у одного, в то время как у остальных предполагали
наличие прободения стероидных язв, что привело к ненужным и опасным
хирургическим вмешательствам.
Хлортиазидные панкреатиты. В 1959 г. Johnston сообщил о
четырех случаях острого панкреатита у больных, которых долгое время лечили
хлортиазидом. Позже появились сообщения о поражениях поджелудочной железы и при
лечении другими салуретиками - гигротоном (салуретин, хлорталидон и др.),
эзидрексом (гидрохлортиазид) и др.
Патогенетические механизмы поражений поджелудочной железы при продолжительном
лечении салуретиками не уточнены. Прямого поражения панкреатических структур
этими лекарственными средствами и их метаболитами не обнаружено. Вероятнее
предположить аллергическую природу поражения. По наблюдениям Schanklin
салуретики повышают секрецию антидиуретического гормона, что приводит к
увеличению вязкости секретируемого панкреатического сока, который может оседать
в канальцах и приводит к задержке сока со всеми ее последствиями. Cornisch
наблюдал различные по степени повышения энзимных величин в крови у 10 из всего
20 больных, которых лечили хлортиазидом; теми же авторами получены в 7,1%
тяжелые некротические изменения поджелудочной железы у мышей, которым вводили
этот диуретик в течение месяца.
Клинические и лабораторные данные хлортиазидных панкреатитов такие же, как и
при стероидных пенкреатитах.
Поражения поджелудочной железы наблюдались и при лечении большими дозами
витамина, изониазидом, антикоагулянтами, тетрациклином, 6-меркаптопурином,
некоторыми противоглистными средствами, например, димандином, фуропромидином и
др. сообщают о двух случаях острого приступа панкреатита у больных хроническим
рецидивирующим панкреатитом после попытки исследования желудочной секреции
гнетам ином.